1.氢原子能级
2.氢原子波函数
单个单电子原子的轨道 单个多电子原子的轨道 多个多电子原子的轨道
Ha=Ea 薛定谔方程
哈密顿量是电子与原子的动能、势能、的总和。对于氢原子,能级就是单个电子和原子核的结合能
密度泛函理论就是用多个多电子原子的哈密顿量来解能量,没有波函数,因为波函数等价于电子密度。
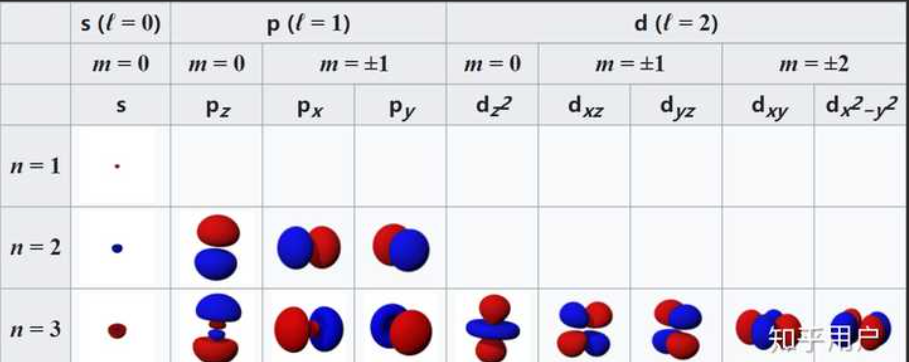
三个主量子数 n l m 极坐标系中的量子数,和波函数的公式相关
n 能级
l角量子数 l=0 - n-1
m 磁量子数 m= -l - +l
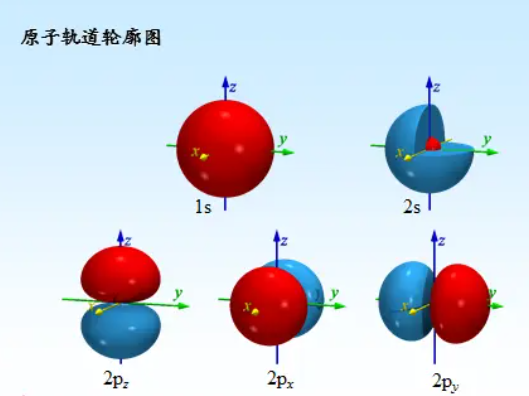
s轨道 l=0
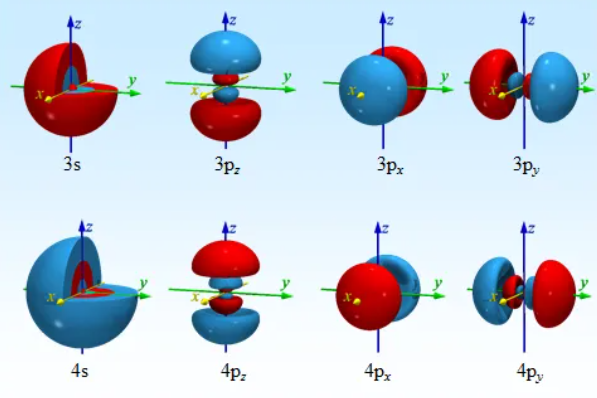
p轨道 l=1 pz l=1 m=0 px/py l=1 m=1/-1
波函数a100 - n=1 l=0 1s
a200 2s
波函数a210 - n=2 l=1 2pz
a211 - 2px/2py
a21-1 = a211
3dxy 3dyz 3dz2 3dxz 3dx2-y2
在氢原子中,s和p轨道的能量都是兼并的
一个电子和一个原子核的解都是类似氢原子的,加一个Z个电荷
三个主量子数的原因是描述一个三维的轨道(为什么是三维的)
对主量子数n,有$n^2$个简并的轨道(对单个氢原子而言)
波函数的样子(主要是s轨道的径向分布)
波函数的样子和平方的样子是一个意思,只不过做一个平方而已,对于特定的r,大的更大,小的比较小,对特定的角度也是这样
s 球 靠近核的地方密度大,概率大
波函数分为两个可分离的部分,径向波函数和角向波函数。径向波函数是和原子核距离R的函数,角向是相对原子核角度的波函数
a=R(r)*Y()
a100的解角度为固定值



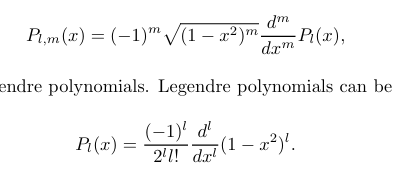

1s轨道
$$
\Psi_{100}=2{a_0}^{\frac{-3}2}e^{\frac{-r}{a_0}}*\sqrt{\pi/4}
$$
2s轨道
$$
\Psi_{2 00}=\frac1{\sqrt2}{a_0}^{\frac{-3}2}(1-\frac{r}{2a_0})e^{\frac{-r}{2a_0}}*\sqrt{\frac{\pi}4}
$$
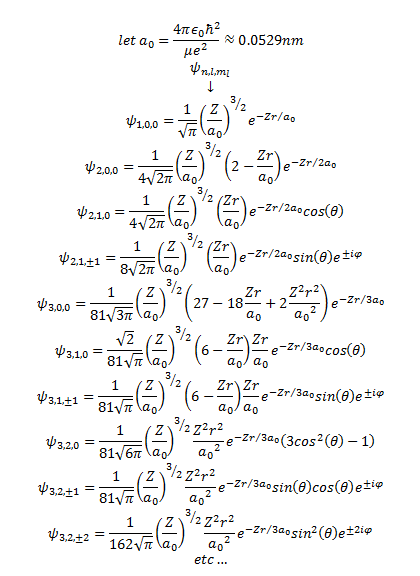
Z:核电荷数
s轨道的波函数都是球,因为l=0 m=0对应一个常数
pz是一个球 l=1 m=0
px和py是椭球 l=1 m=+-1
对于不同主量子数的p轨道,其角向分布函数分别是相同的,区别是径向分布函数,但是径向分布函数是只与R相关的函数,也就是径向分布函数只随着距离的变化而变化,和角度无关。也就是随着半径增加疏密程度的变化,决定形状的是角向分布函数
也就是说对于不同的主量子数,其相同类型的轨道具有相同的角度形状
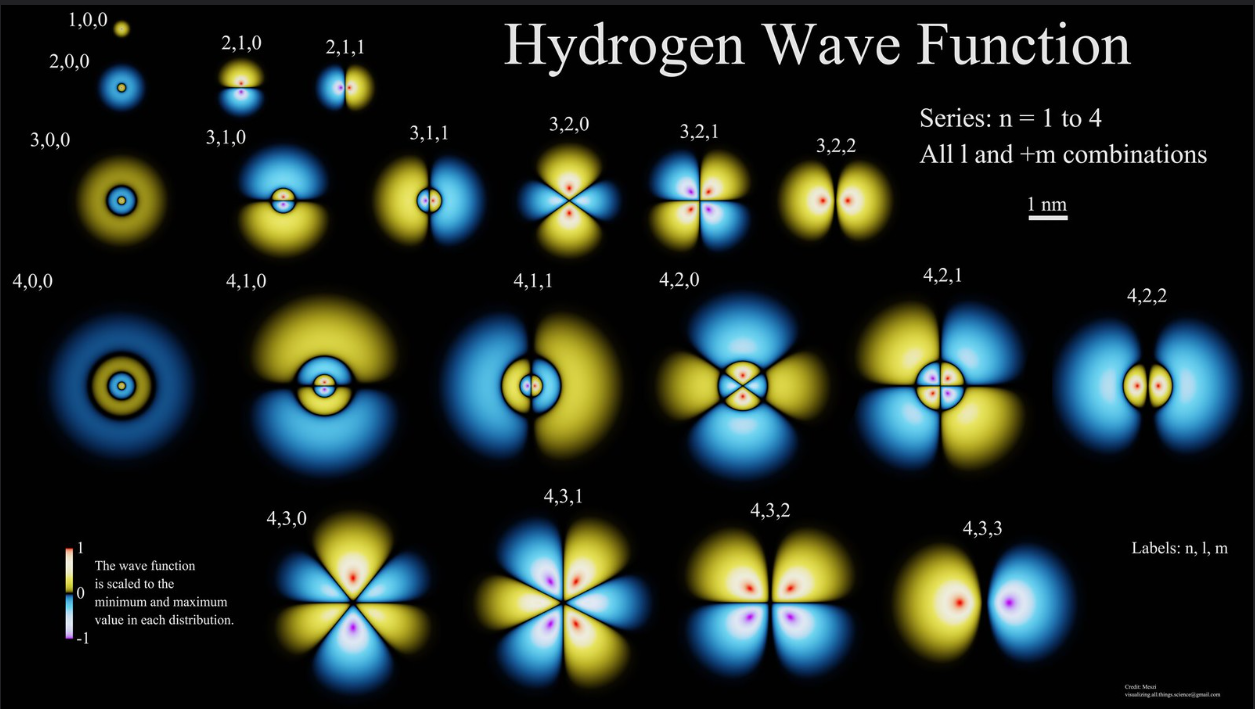

波函数本身可以是负的,但是负号没有值的含义,平方还是正的
下图是波函数平方,也就是概率密度,和波函数形状一致波函数形状和概率密度形状一致,通过波函数就能看到电子概率的分布情况
径向的分布情况
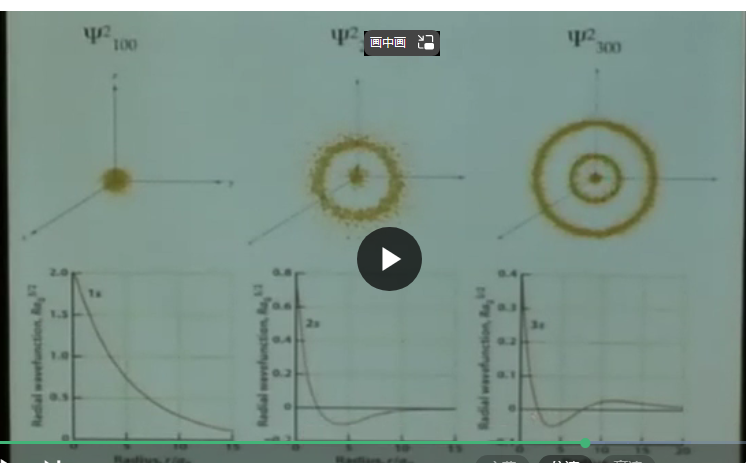
1s 2s 3s
对于电子分布,波函数正负的意义不大,但是对于成键比较重要。成键是电子云的叠加
能量-概率密度(轨道比较形象,就是电子的运动空间)
把氢原子所有轨道叠加起来就是它的整体的电子云,当然是一个球形了,因为所有轨道的能量是简并的。如果能量不简并,那它就只能在特定的轨道上运动了,也就有特定的轨迹,对氢原子,相当于是给区域分了类
当然,如果被激发后,能量就不同了,但是还是可以在s或者p或者d轨道上,主量子数变化但是轨迹分布还是可以随意走的
径向节点数量:主量子数-1-L
1s 0 2s 1 3s 2 4p 2
同一角量子数下不同的磁量子数对应的波函数的形状相同吗,节点数目相同
玻尔半径:概率最大值 (概率/体积)
电子并不是绕着原子核旋转的!要看能量,能量如果简并,就在这些简并轨道运动,如果不简并,就在特定轨道运动
p轨道
==l m决定了角向分布函数,n,l决定径向波函数== ,不同的径向波函数也可以有相同的角向分布
能带是晶体整体的所有电子的排布下的分列能级,或者分列轨道,也就对应着所有可能的电子能量分布。能带就是一个能级分布。一个能级可以对应多个轨道。每个轨道都可以填充两个电子。组成晶体后,有多少能级呢,无穷个,对应倒空间中无穷个点。通过特定的k点连线,得到最低能级。每个能级还可能是简并的,无法区分出来轨道的具体形状。

2s 3s 的概率密度,激发后,最大可能位置变得更远 基态为a_0

波粒二象性使得粒子可以不经过b而从a到达c (驻波)
p轨道 有三个轨道 px py pz(m=0)
三个轨道的区别在于节面的位置不同,最大值位置不同,相位分布不同(大于x或者y,或者z为正)pz在xy平面 px在yz平面
p轨道的角向节点为L 总节点数为n-l-1+l=n-1
对于2p轨道,没有径向的节点(径向的连续空白区域,只有角向的,也就是没有在某一位置处有一个球形的节点)
2p轨道的最可能概率半径要小于2s,也就是2p更靠近原子核。p轨道比s轨道更靠近原子核。
主量子数越大,每个轨道平均都离原子核更远。
现在不是经典的静电势图景,离原子核近的地方也可以能量比较大在经典的图像中,能级对应的轨道是确定的。这是波尔的错误
n不变,随着l增加,最可能几率半径 降低 3d<3p<3s,但是能够以大概率接近原子核的轨道是3s>3p>3d 最可能和最近不同。
对于一个多电子原子,s轨道最不容易被屏蔽,因为s轨道可以有最大概率更接近原子核
s电子既最远离原子核也最容易接近原子核
电子自旋
$m_s$=+-1/2
三个量子数描述轨道,第四个量子数描述电子的状态
四个量子数是对电子的准确描述
每个轨道有两个电子
3.多电子原子
多电子原子的波函数方程不可能解出(多体问题)
单电子轨道近似
分别考虑多电子原子中的每一个电子,都是一个多电荷原子加一个电子,这样可以使用氢原子能级来表示,只是在波函数中增加一个Z,多电子将依次地从低能级开始占据高能级,能级对应的主量子数不止是n,还和l有关。(一个是能级,一个是波函数,分清楚)但是这样做忽略了电子间的排斥作用。
Hartree 轨道:单电子轨道近似 (薛定谔波函数地解) why?
Lithium A = A1×A2*A3 A100 A100 A200 1s2 = 1s×1s
电子组态是根据Hartree轨道写出的,周期表中的电子组态并不真实
Hartree轨道和氢原子波函数地相似性与区别
相似性
形状相似(总节点 n-1 角向节点 l)
相同的节点数量
区别
多电子原子的单轨道近似比对应的氢的轨道更小(核电荷数更多)
轨道能量不仅依赖于n,也依赖于l
轨道的能量比氢对应的轨道能量低

通过确定电子的能量,可以确定电子的波函数/轨道
屏蔽效应:电子间的相互作用抵消吸引力 内层离子屏蔽外层
角量子数的能量顺序
2p轨道比2s轨道更近,但是2s轨道可以距离原子核的距离更近,因此受到的屏蔽更小,使得s轨道感受到的Z_eff更大,对应到能级上,-ZR/n2 轨道的能量更小
同理 E3s<E3p<E3d
多电子原子洪特规则
电子优先占据不同的波函数/轨道,而不是相同的波函数/轨道 电子尽可能进入不同的轨道来减少相互的斥力,从而降低能量
第四个量子数要求要首先平行,即自旋相同
周期:= 主量子数 n
核电子被紧紧束缚在原子核周围,常温下只有价电子能够被激发(毕竟温稠密物质内层会被激发),离核最远
==第四周期 4s低于3d 能级上低==,但是波函数的距离上呢,应该同样是靠的更近,因为近的电子电子能量低?
Cr 4s15d5 Cu 4s13d10
3d在没有电子填充时比4s高,所以先填充4s,但是当有一个电子填充到3d时,3d的轨道就比4s能量低了,这时候如果要产生离子,是从4s来拿的
光电子能谱
X-ray photoelectron spectroscopy
实验上确定不同的能级
测量不同原子打出来后的剩余动能
==外层价电子和内层电子的能量差距很大==,化学反应和化学过程主要考虑价电子
对于Al和Na,最外层电子感受到屏蔽效应,但是不能完全屏蔽,导致Al的最外层电子感应到的有效电荷量还是多过Na,因此能量更低
元素周期律
门捷列夫 根据元素性质对元素分类
1、2主族化学性质活泼 :最外层容易失去电子 得到更低的能量 (每电子,类似相图中的每原子)
N不活泼因为是半满的
- 电离能(默认指第一电离能,第一束缚能)
向右,第一电离能逐渐升高,因为z是增加的,有效电荷量在增加,l的作用不明显
向下,第一电离能降低,因为主量子数增加,距离被很大降低了(概率上),n起主要作用
半满/全满会降低电离能,但是不会降低到小于隔着的上一个。Li<B<Be
中性B原子中打出2s和B+中打出一个2s是不同的,B+中的2s电子的屏蔽效应更小,使得感受到的电荷量更大,因此能量更低,更难打出来
电子亲和能 (得到一个电子的能力)
Cl- 比Cl更稳定,会放出能量
==电离能是正的,表示打出一个电子需要的能量;电子亲和能可以是正或者负,表示增加一个电子的能量的负数;电子亲合能等于增加电子后能量变化的负值,正数越大表明越容易得到电子==,是两个不同的物理过程,
N的电子亲和能是正的
向右电子亲和能增加,向下增加
电负性:一个原子吸引另一个原子的电荷密度的能力
正比于1/2(电离能+电子亲和能) 越难打出,越容易嵌入,则电负性越大
从周期表向右电负性增加,向下电负性减小
原子半径 ==(没有确定的半径,百分之90的电子密度所在的地方)==
向右减小,向下增加
等电子原子/等电子离子:和原子具有相同的电子排布的离子
O2- F- Ne Na+ Mg2+
负离子比本体原子要大,正离子比本体原子要小。F- 比O2- 要小,因为束缚能力更小
共价键
键:如何放置两个原子核和电子的位置,使得它们的能量最低(低于两个原子分开的时候
两个原子共用一对电子
成键强度:成键之后能量降低了多少
键长:两个原子核之间的距离
成键的原因:其中一个原子的电子与另一个原子核的吸引力,因为电子的屏蔽效应并不是完全的
离解能=键的强度 :把分子分开为两个原子的能量
N2分子的成键强度大于H2,键长更短
Lewis structures 路易斯结构(经验规律)
要点:每一个原子都达到价壳层填满;电子共用
F 7个价电子:
转载请注明来源 有问题可通过github提交issue